Selektywna absorpcja i poszczególne narządy
Gdy substancje radioaktywne są pobierane przez organizm, mają tendencję do gromadzenia się w różnych tkankach i narządach (patrz rysunek poniżej). Jak już wiemy, jeśli nie ma wystarczającej ilości wapnia w organizmie i nie jest on łatwo dostępny, organizm będzie pobierać stront-90 lub inne pierwiastki promieniotwórcze, które są podobne do wapnia, takie jak bar-140 i rad-226, i odkładać je w zębach i kościach. Kiedy już taki promieniotwórczy stront zostanie wbudowany, napromieniowuje pobliskie komórki. Może to zakłócić normalne funkcje organizmu i doprowadzić do rozwoju raka w przyszłości.
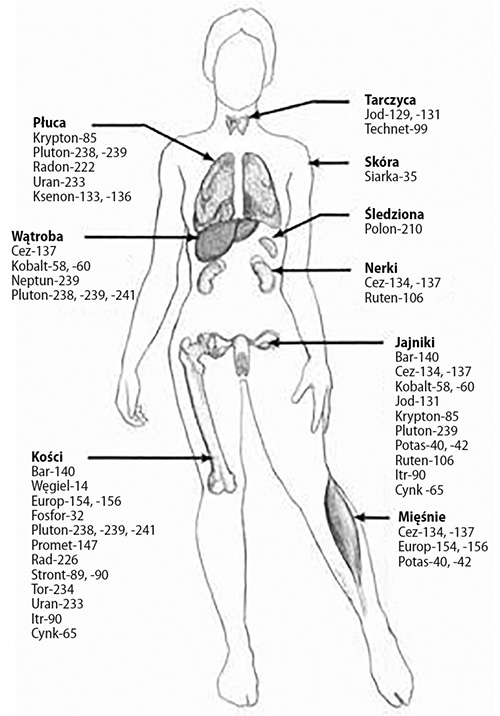
Miejsca odkładania się radioizotopów w organizmie człowieka
Cez-137 to kolejny długowieczny pierwiastek, który występuje we wszystkich opadach radioaktywnych oraz emisjach z elektrowni jądrowych. Jest radioizotopem należącym do tej samej grupy, co potas. Przechwycony przez organizm w razie braku potasu zostaje skoncentrowany w mięśniach i narządach płciowych, szczególnie w jajnikach. (W tych miejscach organizmu odkładają się także radioaktywne formy potasu: potas-40 i potas-42).
W kwietniu 1974 roku czasopismo Health Physics opublikowało artykuł, w którym napisano: „...szczegółowe informacje na temat transportu cezu są pilnie potrzebne w związku z procesami włączania i wyłączania zachodzącymi w biosferze zanieczyszczonej radioaktywnym cezem”.
Zanieczyszczenie biosfery jest poważną sprawą. Biosfera obejmuje całe nasze środowisko na powierzchni Ziemi – lądy, wody i atmosferę, które służą wszystkim żywym istotom.
Jod jest składnikiem odżywczym, który jest wykorzystywany przez gruczoł tarczycy do wytwarzania pewnych hormonów. Zawierające jod hormony pełnią ważną rolę w regulacji procesów zachodzących w organizmie. Jeśli ilość jodu w diecie jest niewystarczająca, organizm będzie przyswajał radioaktywny jod-131, aby zaspokoić swoje potrzeby i nasycić tarczycę.
Promieniotwórczy jod może być wdychany w postaci gazu bądź spożywany w postaci soli jodu. W każdym przypadku, gdy jod-131 migruje do tarczycy, napromieniowuje pobliskie komórki i w zależności od swojej ilości może zakłócać jej funkcje albo wywołać raka w późniejszym czasie.
W swojej książce Nuclear Madness (Jądrowe szaleństwo) z roku 1979 doktor medycyny Helen Caldicott podaje, że czas pomiędzy wychwytem przez tarczycę jodu-131 a wykształceniem raka może wynosić „od dwunastu do pięćdziesięciu lat”. Inne poważne problemy pojawiają się, gdy jod-131 gromadzi się w tarczycy rozwijającego się płodu. Prowadzi to do zmniejszenia tempa wzrostu, niskiej masy urodzeniowej i zwiększonej śmiertelności niemowląt.
Opublikowany w sierpniu 1977 roku przez Krajową Radę Pomiarów i Ochrony przed Promieniowaniem (National Council on Radiation Protection and Measurements; w skrócie NCRP) raport nr 55 zatytułowany „Ochrona tarczycy w przypadku uwolnienia radioaktywnego jodu” sugeruje, że jodek potasu można uznać za środek awaryjnego „blokowania” tarczycy. Ten przypadek znajduje wyjaśnienie w zasadzie selektywnego wychwytu. Zawarty w jodku potasu jod nieradioaktywny zostaje wchłonięty przez tarczycę w takim stopniu, że nie jest ona w stanie wchłonąć więcej jodu. W ten sposób zablokowany zostaje wychwyt radioaktywnego jodu przez organizm. Więcej o jodzie można przeczytać w VII rozdziale mojej książki.
W owym raporcie NCRP zaproponowano również składowanie związków jodu na potrzeby sytuacji awaryjnych. Wkrótce po awarii elektrowni jądrowej w Three Mile Island w roku 1979 i w Czarnobylu w roku 1986 rozdawano preparaty jodu, takie jak jodek potasu, w miejscach, w których ludność była narażona na promieniowanie. Była to próba ograniczenia wchłaniania jodu-131. Oczywiście, to tylko częściowe rozwiązanie kwestii zagrożeń dla zdrowia stwarzanych przez radioaktywny pył, ponieważ chroni ono ludzi tylko przed działaniem tego jednego pierwiastka.
Jak dotąd nie słyszałam o szeroko zakrojonych planach dystrybucji środków blokujących inne pierwiastki promieniotwórcze. Skoro działanie tej zasady zostało potwierdzone w przypadku jednego zestawu promieniotwórczych i stabilnych pierwiastków, zastanawiam się, dlaczego nie zastosowano jej do innych grup pierwiastków.
Pluton, którego okres połowicznego rozpadu wynosi tysiące lat, jest pierwiastkiem radioaktywnym o podobnej strukturze do żelaza. Może być wchłaniany przez ludzką krew i przenoszony do komórek składowania żelaza w wątrobie i szpiku kostnym, w którym pozostaje, podobnie jak inne radioizotopy, napromieniowując pobliskie komórki.
Zdaniem dr Caldicott: „Przypominające żelazo właściwości plutonu pozwalają temu pierwiastkowi przekraczać bardzo selektywną barierę łożyska i docierać do rozwijającego się płodu, co może powodować… uszkodzenie i kolejne rażące deformacje u noworodka”.
Radioaktywny cynk-65 może zostać włączony do organizmu w miejsce stabilnych form tego pierwiastka i być odkładany w kościach i narządach rozrodczych.
Kobalt-60 może być wykorzystywany zamiast stabilnych form tego pierwiastka przez mikroorganizmy wytwarzające witaminę B12. Witamina B12 jest złożonym związkiem biorącym udział w syntezie czerwonych krwinek i DNA. Ponadto odgrywa ważną rolę w utrzymaniu w zdrowiu układu nerwowego. Organizm przechowuje witaminę B12 przez długi czas.
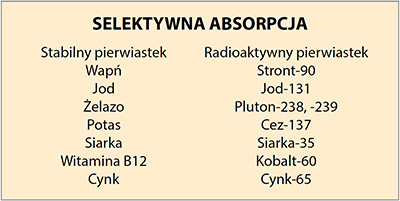
Poniższa tabela przedstawia stabilne pierwiastki blokujące wychwyt pierwiastków radioaktywnych. Trwałe pierwiastki wymienione w kolumnie po lewej blokują wchłanianie pierwiastków promieniotwórczych wymienionych w kolumnie po prawej stronie. (Stabilne izotopy jodu, siarki i cynku to jod-127, siarka-32 i cynk-64). Witamina B12 jest związkiem zawierającym kobalt. (Stabilny kobalt to kobalt-59).